4.2. Тройная диаграмма фазовых равновесий системы
с эвтектическим превращением
Пространственные диаграммы состояния
трехкомпонентных систем строят при р или T = const. Температуру (или давление) фазовых превращений на
таких диаграммах откладывают по оси ординат, а основанием диаграммы является
плоскость, на которой показывают состав системы – концентрационный треугольник.
Пример такой диаграммы при p=const представлен на рис. 4.4.
Диаграмма построена для системы, состоящей из висмута, свинца
и олова, которые неограниченно растворимы друг в друге в жидком и не растворимы
в твердом состоянии. В этой системе нет ни твердых растворов, ни
химических соединений.
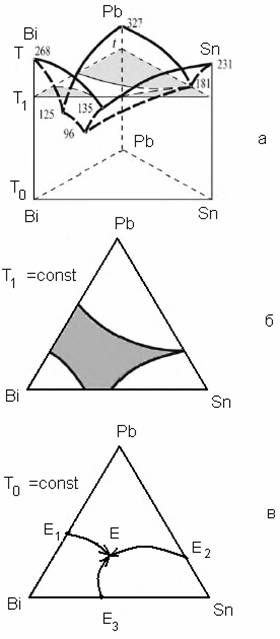
Рис. 4.4. Диаграмма фазовых равновесий
для системы
Pb–Bi–Sn:
a – трехмерное изображение;
б – сечение диаграммы при Т1;
в – концентрационный
треугольник для данной системы
Пространственная диаграмма системы представляет собой
трехгранную прямоугольную призму, в основании которой лежит концентрационный
треугольник (рис. 4.4, в), а грани образованы бинарными системами
(диаграммы с эвтектичесим равновесием). Точки Е1,
Е2, Е3 – точки эвтектики
бинарных систем (проекции точек эвтектики) на концентрационном треугольнике.
Точка Е – точка тройной эвтектики.
Внутри призмы: поверхность, образованная совокупностью точек температуры начала кристаллизации расплава данного
состава, является поверхностью ликвидуса данной трехкомпонентной системы. Поверхность
солидуса представляет собой плоскость, проходящую
через точку тройной эвтектики при температуре тройной эвтектики (на рисунке не
изображена). Рис. 4.4, а представляет собой сечение диаграммы при
какой-то заданной температуре Т1 =const.
Для двухкомпонентных систем Pb–Bi, Bi–Sn, Sn–Pb эвтектические точки соответствуют температурам 125, 135 и
181 °С соответственно. Тройную эвтектику
образует трехкомпонентная система, содержащая 52,5 масс. % Bi,
32,0 масс. % Pb и 15,5 масс. % Sn, которая является наиболее легкоплавкой смесью, температура
ее плавления равна 96 °С.
Такие диаграммы наглядно могут представлять изменение состава системы в зависимости от температуры и проводить количественные расчеты. Для расчетов системы пользуются в основном концентрационным треугольником (рис. 4.4, в). Линии ЕЕ1, ЕЕ2, ЕЕ3 на концентрационном треугольнике называют пограничными линиями. Линия, соединяющая вершины, – Pb–Bi–Sn – в общем случае называется соединительной линией. Для определения состава фаз и их относительного количества пользуются, как и в случае двухкомпонентных систем, конодами и правилом рычага.
Основные правила построения и расчетов с использованием концентрационного треугольника:
температура на пограничных линиях всегда падает в направлении от точек пересечения с соединительной линией в глубь треугольника до точки эвтектики (обозначено стрелками на рис. 4.4, в);
при кристаллизации первично выпадающей твердой фазой является та фаза, в поле кристаллизации которой проецируется исходная точка сплава;
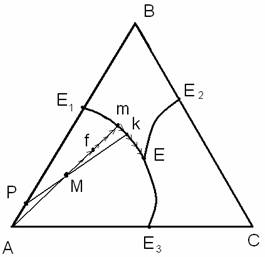
для определения пути кристаллизации расплава на треугольнике
следует провести прямую, соединяющую проекцию точки исходного сплава на
концентрационном треугольнике с вершиной треугольника, относящейся к данному
полю. Путь кристаллизации проходит по этой прямой до встречи с пограничной
линией, далее по этой линии до точки общей эвтектики Е, где и заканчивается
кристаллизация (см. на рис. 4.5).
|
|
|
Рис. 4.5.
К определению пути кристаллизации и относительного количества фаз
Для исходного сплава, состав которого отвечает точке М, первично
выпадающей фазой является твердое А, а путь
кристаллизации проходит от точки M по
отрезку Мm, а затем по
кривой mE.
В точке f относительные
количества твердой фазы GA и жидкой фазы Gж соотносятся между собой как отношение отрезков GA : Gж = Mf : AM. В точке k в равновесии существуют две твердые
фазы (А и В) и жидкая фаза.
Относительные количества всей твердой фазы GA+В и жидкой фазы Gж соотносятся между собой как отношение отрезков GA+В : Gж = Mk : PM. Относительные количества
каждой из твердых фаз находятся из соотношения GA
: GВ = PB : PA.